2021年11月5日,美国德克萨斯大学西南医学中心的Lora V. Hooper课题组胡泽汗和张晨璐等研究人员在Science杂志上在线发表了题为Small proline-rich protein 2A is a gut bactericidal protein deployed during helminth infection 的研究论文。研究团队鉴定了一种新型肠道抗菌蛋白,揭示了其在机体肠道微生物组成调控、肠黏膜抗菌屏障维持以及抵抗一些革兰氏阳性病原菌(例如李斯特菌)入侵过程中的作用。这一研究同时也揭示了该蛋白可以在肠道寄生虫感染条件下通过IL-4/13-STAT6通路诱导表达,帮助肠上皮细胞在该条件下维持肠黏膜抗菌屏障。

首先,通过比较无菌小鼠在定植肠道微生物前后肠上皮细胞的转录组变化,该团队发现富含脯氨酸的小蛋白 2A(Small proline-rich protein 2A,SPRR2A)的表达水平在肠道菌群定植以及病原菌感染情况下会显著上调。细胞生物学研究显示该蛋白在小鼠肠上皮细胞中的潘氏细胞(Paneth cells)和杯状细胞(Goblet cells)中高表达,并能分泌至肠腔中。SPRR2A转录本在inflammatory bowel disease (IBD) 病人的大肠活检组织样本中有找到,而正常人群的大肠细胞则没有发现。进一步的表达实验确定了SPRR2A的表达通过TLR–MyD88通路受到肠道菌群的调控。
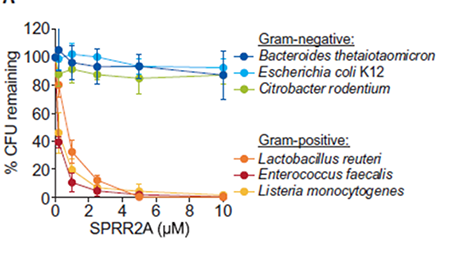
体外生化研究揭示该蛋白可以通过裂解细菌细胞膜选择性地杀伤革兰氏阳性细菌,是一类新型的肠道抗菌蛋白。SPRR2A蛋白在低盐浓度下和酸性环境中工作,SPRR2A蛋白结合带负电荷的脂类,并可破坏带负电荷脂类的脂质体。与此前发现的形成膜孔的抗菌蛋白REG3A和RELMβ不同【2, 3】,SPRR2A改变膜通透性在脂质体实验中可造成不同大小的荧光染料流出,说明SPPR2A不同于REG3A和RELMβ的工作机制。SPPR2A蛋白同时富含半胱氨酸,二硫键的形成对其抗菌活性至关重要。基于该基因敲除小鼠的体内研究进一步揭示该蛋白在机体维持肠道微生物稳态、维持肠上皮的抗菌屏障以及抵抗一些革兰氏阳性病原菌(例如李斯特菌)的入侵中发挥重要作用。
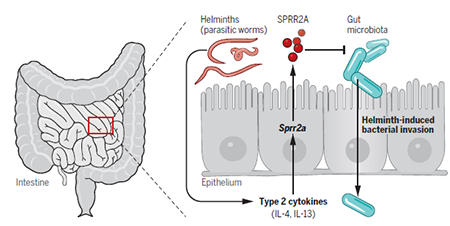
目前已知肠道中存在大量不同种类的抗菌蛋白,那么为什么机体还需要进化出这种新型的抗菌蛋白?SPRR2A蛋白又具有哪些与众不同的特性?为了回答这些问题,研究人员发现当小鼠在被肠道寄生虫感染时,其肠上皮细胞中众多已知抗菌蛋白(例如 Lysozyme、α-defensin 以及 REG3 家族蛋白等)的表达会出现显著降低【4】,但此时肠道黏膜抗菌屏障功能并没有出现明显减弱,提示应该有其它新的抗菌蛋白弥补了该功能。进一步研究发现SPRR2A蛋白可以在寄生虫感染时通过 IL-4/13-STAT6 通路的激活而显著提高,当用寄生虫感染Sprr2a-/-小鼠肠道后,其肠道组织以及肠系膜淋巴结(mLN)中出现了大量的肠道菌群易位,提示其肠黏膜抗菌屏障受损。因此,SPRR2A作为一种新型可以被2型免疫反应诱导表达的抗菌蛋白,对于机体在遭受肠道寄生虫感染时维持肠道的抗菌屏障功能起着至关重要的作用。
综上,SPRR2A作为一种新型肠道抗菌蛋白,在肠道细菌和寄生虫定植/感染时通过两条相对独立的信号通路(TLR-MyD88通路和IL-4/13-STAT6通路)被诱导表达,协助机体抵御外源生物的感染,维持肠道的稳态平衡。同期Science发表了专门的评述A helminth-induced antimicrobial protein,评述指出这项研究不仅发现了新的肠道抗菌蛋白,通过对其调控和作用机制的解析更帮助我们揭示了多物种-人类,寄生虫和肠道菌群之间的复杂控制和相互影响。
文章链接:https://doi.org/10.1126/science.abe6723













